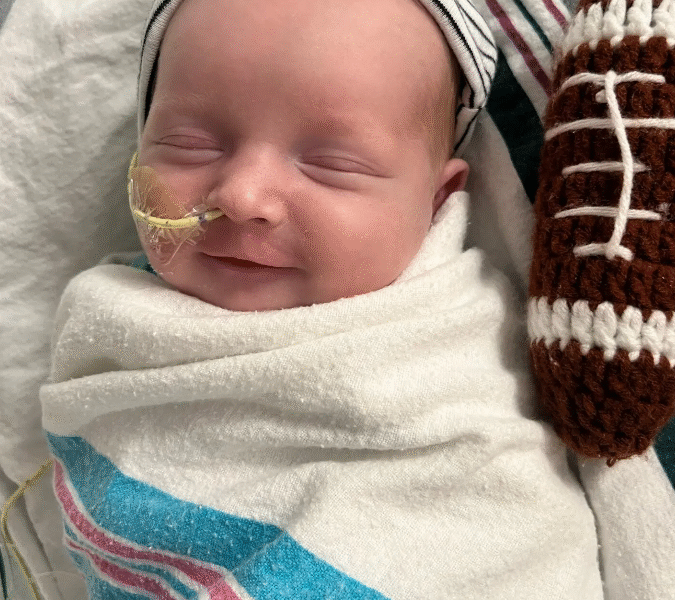
El niño de 9 meses y medio con una enfermedad genética rara recibió una infusión hecha solo para él y diseñada para corregir su mutación exacta.
Algo muy grave sucedía con el bebé de Kyle y Nicole Muldoon.
Los médicos especularon. ¿Quizá era meningitis? ¿Quizá sepsis?
Obtuvieron una respuesta cuando KJ tenía solo una semana. Tenía un raro trastorno genético, la deficiencia de Carbamil-fosfato Sintetasa (CPS1, por su sigla en inglés), que afecta solo a uno de cada 1,3 millones de bebés. Si sobrevivía, tendría graves retrasos mentales y del desarrollo y con el tiempo necesitaría un trasplante de hígado. Pero la mitad de los bebés con este trastorno mueren en la primera semana de vida.
Los médicos del Hospital Infantil de Filadelfia ofrecieron a los Muldoon cuidados paliativos para su bebé, la posibilidad de renunciar a tratamientos agresivos ante un pronóstico sombrío.
“Lo amábamos y no queríamos que sufriera”, dijo Nicole Muldoon. Pero ella y su marido decidieron darle una oportunidad a KJ.
En cambio, KJ ha hecho historia en la medicina. El bebé, que ahora tiene 9 meses y medio, se convirtió en el primer paciente de cualquier edad en recibir un tratamiento de edición de genes personalizado, según sus médicos. Recibió una infusión hecha solo para él y diseñada para corregir su mutación exacta.
Los investigadores que dirigieron el esfuerzo por salvar a KJ presentaron su trabajo el jueves en la reunión anual de la Sociedad Americana de Terapia Celular y Genética, y también lo publicarán en el New England Journal of Medicine.
Las implicaciones del tratamiento van mucho más allá de haber tratado a KJ, dijo Peter Marks, quien era el funcionario de la Administración de Alimentos y Medicamentos que supervisaba la regulación de la terapia génica hasta que renunció recientemente por desacuerdos con Robert F. Kennedy Jr., secretario de Salud y Servicios Humanos. Más de 30 millones de personas en Estados Unidos padecen una de las más de 7000 enfermedades genéticas raras. La mayoría son tan poco comunes que ninguna empresa está dispuesta a dedicar años a desarrollar una terapia génica que tan pocas personas necesitarían.
Pero el tratamiento de KJ —que está basado en décadas de investigación financiada por el gobierno federal— ofrece una nueva vía para que las empresas desarrollen tratamientos personalizados sin pasar por años de costosos desarrollo y pruebas.
Las enfermedades como la de KJ son el resultado de una sola mutación: una letra incorrecta en el ADN entre las tres mil millones que componen el genoma humano. Corregirla requiere un enfoque de precisión denominado edición de bases.
Para conseguirlo, el tratamiento se envuelve en moléculas de lípidos grasos para protegerlo de la degradación en la sangre en su camino hacia el hígado, donde se realizará la edición. Dentro de los lípidos hay instrucciones que ordenan a las células producir una enzima que edita el gen. También llevan un GPS molecular, el CRISPR, que se modificó para que se arrastre por el ADN de una persona hasta encontrar la letra exacta del ADN que hay que cambiar.
Aunque el tratamiento de KJ se personalizó para que el CRISPR encontrara únicamente su mutación, el mismo tipo de método podría adaptarse y utilizarse una y otra vez para arreglar mutaciones en otros lugares del ADN de una persona. Solo habría que cambiar las instrucciones del CRISPR que conducen al editor al punto del ADN con la mutación. Los tratamientos serían más baratos, “al menos en un orden de magnitud”, dijo Marks.
El método, dijo Marks, quien escribió un editorial que acompaña al artículo de investigación, “es, para mí, una de las tecnologías potencialmente más transformadoras que existen”.
Con el tiempo podría utilizarse también para trastornos genéticos más comunes, como la anemia falciforme, la fibrosis quística, la enfermedad de Huntington y la distrofia muscular.
Y, dijo, “podría transformar realmente la atención médica”.
La historia del tratamiento de edición de genes a medida para KJ empezó la tarde del 8 de agosto, cuando Kiran Musunuru, investigador de edición de genes de la Universidad de Pensilvania, recibió un correo electrónico de Rebecca Ahrens-Nicklas, del Hospital Infantil de Filadelfia. Había nacido un bebé, y las pruebas genéticas mostraban que tenía deficiencia de CPS1.
¿Podría salvar al bebé?
Musunuru había empezado a investigar el uso de la edición de genes para mutaciones de genes bastante comunes.
Desarrollar un editor de genes para tratar a los pacientes es un proceso deliberado que puede llevar años. Pero KJ no tenía años que esperar: quizá tan solo seis meses antes de que aumentara el riesgo de daño cerebral grave o muerte.
“En ese momento, el reloj se pone en marcha en mi mente”, dijo Musunuru. “Esto es la vida real. Esto no es hipotético”.
La enfermedad de KJ está causada por la incapacidad del organismo para eliminar el amoníaco, un subproducto del metabolismo de las proteínas. El amoníaco se acumula en la sangre y pasa al cerebro. Sus médicos le sometieron a una dieta que restringía mucho las proteínas, lo justo para que creciera. También le administraron un medicamento, fenilbutirato de glicerol, que le ayudaba a eliminar el amoníaco de la sangre. Pero seguía corriendo un alto riesgo de lesión cerebral o muerte. Cualquier enfermedad o infección podía disparar sus niveles de amoníaco y causarle daños irreversibles en el cerebro.
KJ vivía en el hospital bajo cuidados las 24 horas del día.
Construir un sistema de edición de genes para el bebé de los Muldoon y ponerlo a prueba no fue fácil.
“Hubo que actuar rápido en muchos casos”, dijo Musunuru.
Musunuru empezó a trabajar con Fyodor Urnov, de la Universidad de California, campus Berkeley, quien se aseguró de que no hubiera ediciones inesperadas y deletéreas de genes en otras partes del ADN. Urnov forma parte de una colaboración académica con Danaher Corporation, una empresa capaz de producir el editor de genes para KJ a un nivel que permitiría utilizarlo en un paciente.
Danaher colaboró a su vez con otras dos empresas de su propiedad, otras dos empresas de biotecnología y otro instituto de investigación, dijo Sadik Kassim, su director de tecnología para medicamentos genómicos.
“En cada paso del proceso, siempre esperábamos que alguien dijera: ‘No, lo siento’”, dijo Kassim. “Y ese sería el final de la historia”. Pero sus temores fueron infundados. Danaher y las demás empresas solo cobraban por las materias primas para fabricar el medicamento, añadió.
La FDA también facilitó la aprobación reglamentaria del tratamiento, dijo Ahrens-Nicklas.
Decenas de investigadores dejaron de lado todo lo demás durante meses.
En Berkeley, dijo Urnov, “los científicos se quemaron las pestañas en esto con una vela del tamaño de la bahía de San Francisco”. Añadió que “semejante velocidad para producir un CRISPR de grado clínico para una enfermedad genética no tiene precedentes en nuestro campo. Ni de lejos”.
David Liu, de Harvard, cuyo laboratorio inventó el método de edición de genes utilizado para corregir la mutación de KJ, dijo que la velocidad fue “asombrosa”.
“Tradicionalmente, estos pasos llevan la mayor parte de una década, si no más”, dijo.
Solo cuando se dispuso de la solución de edición de genes y la FDA aprobó el trabajo de los investigadores, Ahrens-Nicklas se dirigió a los padres de KJ.
“Uno de los momentos más aterradores fue cuando entré en la habitación y dije: ‘No sé si funcionará, pero prometo que haré todo lo posible para asegurarme de que sea seguro’”, dijo.
La mañana del 25 de febrero, KJ recibió la primera infusión, una dosis muy baja porque nadie sabía cómo respondería el bebé. Estaba en su habitación, en la cuna donde había vivido toda su vida. Tenía 6 meses y estaba en el percentil 7 para su peso.
Musunuru supervisó la infusión de dos horas, sintiéndose, dijo, “emocionado y aterrorizado a la vez”.
KJ durmió durante todo el proceso.
Al cabo de dos semanas, KJ podía comer tantas proteínas como un bebé sano. Pero seguía necesitando la medicación para eliminar el amoníaco de su sangre, señal de que el editor de genes aún no había corregido el ADN de todas las células afectadas.
Los médicos le administraron una segunda dosis 22 días después.
Pudieron reducir a la mitad la dosis de medicación. Tuvo algunas enfermedades víricas en ese tiempo, que normalmente habrían desencadenado subidas aterradoras de sus niveles de amoníaco. Pero, dijo Ahrens-Nicklas, “las superó”.
Hace una semana y media, el equipo administró a KJ una tercera dosis.
Es demasiado pronto para saber si puede dejar de tomar la medicación por completo, pero la dosis se ha reducido mucho. Y está lo bastante bien como para que el equipo empiece a planificar su alta hospitalaria. Está cumpliendo los hitos del desarrollo y su peso está ahora en el percentil 40 para su edad, pero aún no se sabe si se librará de un trasplante de hígado.
El resultado “es un triunfo de la inversión del pueblo estadounidense en la investigación biomédica”, dijo Urnov.
Los investigadores destacaron el papel que desempeñó la financiación gubernamental en el desarrollo.
El trabajo, dijeron, comenzó hace décadas con la financiación federal de la investigación básica sobre los sistemas inmunitarios bacterianos. Eso condujo finalmente, con más apoyo federal, al descubrimiento del CRISPR. La inversión federal en la secuenciación del genoma humano permitió identificar la mutación de KJ. La financiación estadounidense apoyó al laboratorio de Liu y su descubrimiento de la edición. Un programa federal para estudiar la edición de genes apoyó la investigación de Musunuru. Paralelamente, hubo trabajos financiados por el gobierno federal que permitieron comprender la enfermedad de KJ.
“No creo que esto hubiera podido ocurrir en otro país que no fuera Estados Unidos”, dijo Urnov.
Aquellos que trabajaron para salvar a KJ estaban orgullosos, dijo Urnov.
“Todos nos dijimos: ‘Esto es lo más importante que hemos hecho nunca’”.